Pre výpočet pH potrebujeme poznať tieto základné vzťahy:
pH = -log[H+] (čítame pH sa rovná záporný dekadický logaritmus koncentrácie vodíkových katiónov)
pOH = -log[OH-]
pH + pOH = 14
Kv = [H+].[OH-] ⟹ Kv = iónový súčin vody (súčin koncentrácii H+ a OH-) = 1.10-14
Príklad: Vypočítajte pH roztoku úplne ionizovanej jednosýtnej kyseliny a koncentráciu vodíkových aj hydroxidových iónov v roztoku, ak viete, že pOH je 10,602 a log2,5 = 0,398.
Riešenie:
Ak pOH je 10,602, pH bude 14 – 10,602 = 3,398
pre pH platí vzťah: pH = -log[H+]
teda:
3,398 = -log[H+]
-3,398 = log[H+]
koncentráciu H+ si môžeme vyjadriť:
[H+] = 10-3,398
Ako ďalej v prípade, že nemáme k dispozícii kalkulačku? Spomeňme si na matematiku: ak máme napríklad x2 * x7, vieme, že je to x2+7 = x9. A, napríklad jednotky látkového množstva:
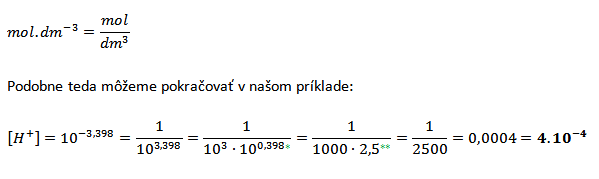 mol/l
mol/l
*3,398 = 3 + 0,398
**zo zadania
[OH-] vypočítame zo vzťahu pre Kv.
Kv = [H+].[OH-]
1.10-14 = (4.10-4) . [OH-]
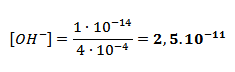 mol/l
mol/l
pH uvedeného roztoku je 3,398, koncentrácia vodíkových katiónov v ňom je 4.10-4 mol/l a hydoxidových aniónov 2,5 . 10-11 mol/l, resp. mol.dm-3.